Syndrome myélodysplasique
Ricarda Schwarz a étudié la médecine à Würzburg, où elle a également obtenu son doctorat. Après un large éventail de tâches en formation médicale pratique (PJ) à Flensburg, Hambourg et en Nouvelle-Zélande, elle travaille maintenant en neuroradiologie et radiologie à l'hôpital universitaire de Tübingen.
En savoir plus sur les experts Tout le contenu de est vérifié par des journalistes médicaux.Le terme syndrome myélodysplasique (SMD) couvre un groupe de maladies dans lesquelles la formation de différents types de cellules sanguines est perturbée. Les symptômes possibles de l'équilibre sanguin perturbé sont l'anémie, une légère tendance aux saignements ou une susceptibilité accrue aux infections. Les causes du SMD restent généralement inexpliquées. Le syndrome myélodysplasique ne survient généralement qu'à un âge avancé, généralement à partir de 60 ans. Ici, vous pouvez lire tout ce que vous devez savoir sur le syndrome myélodysplasique.
Codes CIM pour cette maladie : Les codes CIM sont des codes internationalement reconnus pour les diagnostics médicaux. On les retrouve, par exemple, dans les lettres des médecins ou sur les certificats d'incapacité de travail. D46

Syndrome myélodysplasique : Description
Un syndrome myélodysplasique (SMD, myélodysplasie) comprend un groupe de maladies qui affectent la moelle osseuse et donc la formation du sang. Normalement, différents types de cellules sanguines se développent dans la moelle osseuse à partir de cellules de moelle osseuse immatures (blastes), qui sont responsables de différentes tâches dans le corps. Ceux-ci inclus:
- Globules rouges (érythrocytes) : transport d'oxygène
- Globules blancs (leucocytes) : partie du système immunitaire
- Plaquettes (thrombocytes) : caillots sanguins
Le syndrome myélodysplasique affecte plusieurs de ces lignées cellulaires. Ils sont soit moins instruits, soit leur fonction est limitée. Les types de cellules et la gravité de leur atteinte sont différents. Si deux des trois rangées de cellules sont atteintes, on parle de bicytopénie, si les trois sont atteintes, on parle de pancytopénie. C'est aussi la raison pour laquelle il n'existe pas de "syndrome myélodysplasique". Le terme décrit un groupe de maladies différentes, dont chacune affecte la formation du sang. Dans la plupart des cas, des cellules moins fonctionnelles du type cellulaire affecté peuvent être trouvées (cytopénie). La moelle osseuse, quant à elle, est souvent parsemée de nombreuses cellules immatures (blastes), les cellules précurseurs des cellules sanguines.
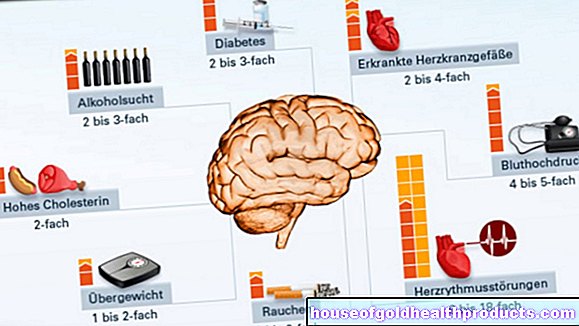
La myélodysplasie est plus fréquente chez les personnes autour de 70 ans. Chaque année, environ quatre à cinq personnes sur 100 000 développent un MDS. Le syndrome myélodysplasique est l'une des maladies malignes du sang les plus courantes. Chez les plus de 70 ans, 20 à 50 personnes sur 100 000 tombent malades. Un peu plus d'hommes (56 %) que de femmes (44 %) développent un syndrome myélodysplasique. L'espérance de vie et l'évolution de la maladie sont déterminées par divers facteurs. Entre autres choses, le facteur décisif est la hauteur de la fraction dite blastique, s'il y a des changements génétiques complexes et à quel point la formation de sang est gravement altérée. Une proportion élevée de blastes indique un niveau élevé d'activité de la maladie et donc un pronostic moins favorable. L'âge et les maladies antérieures jouent également un rôle. Dans l'ensemble, la durée de survie moyenne du SMD est d'environ 30 mois. Dans certains cas, cependant, des écarts importants par rapport à cette valeur moyenne statistique sont également possibles.
Syndrome myélodysplasique : symptômes
Le syndrome myélodysplasique provoque des symptômes chez environ 80% des patients en raison du nombre réduit de certaines cellules sanguines, tandis que le SMD est découvert par hasard dans le reste. La formation perturbée des différentes cellules du sang a des conséquences diverses :
Anémie : la production ou la fonction des globules rouges est altérée
L'anémie survient dans 70 % des cas de SMD, ce qui en fait le symptôme le plus courant de la myélodysplasie. Dans le SMD, la formation normale des globules rouges et de l'hémoglobine est perturbée, ce qui provoque une anémie. L'hémoglobine est le colorant rouge des plaquettes rouges qui les aide à déplacer les gaz. S'il y en a trop peu, il peut y avoir des signes de manque d'oxygène. Les patients se sentent chroniquement fatigués, moins productifs et ont moins de concentration. Si vous faites même peu d'exercice, vous serez essoufflé et ressentirez un pouls rapide (tachycardie). Souvent, les personnes touchées sont sensiblement pâles et se plaignent de vertiges lors de l'effort. Au moment du diagnostic, environ la moitié des patients ont une telle anémie qu'une transfusion sanguine est nécessaire.
Infections : la formation ou la fonction des globules blancs est altérée
Un syndrome myélodysplasique entraîne des infections répétées dans environ 35% des cas. Les personnes touchées ont un faible nombre de globules blancs (leucopénie). Si le nombre de globules blancs est faible, le système immunitaire ne peut plus répondre adéquatement aux agents pathogènes. Le SMD est donc souvent associé à une augmentation des infections, dont certaines s'accompagnent de fièvre.
Tendance hémorragique : la formation ou la fonction des plaquettes sanguines est altérée
Si le nombre de plaquettes sanguines est réduit (thrombocytopénie), des saignements peuvent survenir plus rapidement. Lorsqu'elles sont blessées, les plaquettes aident généralement le sang à coaguler et à arrêter l'écoulement du sang. En conséquence, environ vingt pour cent des personnes atteintes du syndrome myélodysplasique saignent facilement. Cela peut être vu, par exemple, dans de petites hémorragies ponctuelles sous la peau, appelées pétéchies.
Plus de symptômes
Cependant, il existe des symptômes qui ne sont pas directement liés au nombre réduit de cellules dans les cellules sanguines individuelles. Dans 20 à 50 pour cent des cas, par exemple, la rate est agrandie (splénomégalie). Leur fonction est, entre autres, de trier les globules rouges défectueux et obsolètes. Si le nombre de globules rouges non fonctionnels dans la myélodysplasie augmente, la rate doit également augmenter sa charge de travail. Cela devient visible à travers un élargissement de l'organe. Le foie peut également être agrandi (hépatomégalie) et provoquer une sensation de pression sourde dans la partie supérieure droite de l'abdomen. Environ un patient sur dix atteint de SMD développe un cancer des ganglions lymphatiques.
Syndrome myélodysplasique : causes et facteurs de risque
Chez les personnes en bonne santé, les cellules dites souches du sang passent par différentes étapes de maturation et de division dans la moelle osseuse. À la fin de ces processus, des globules rouges, des globules blancs et des plaquettes se forment.Chez les patients atteints de SMD, les cellules souches de la moelle osseuse sont dégénérées et la formation normale du sang (hématopoïèse) est perturbée. Les cellules souches pathologiquement altérées produisent des masses de cellules sans fonction. Ceux-ci meurent rapidement ou sont triés dans la rate. Des trois rangées de cellules dans le sang (globules rouges, globules blancs, plaquettes), une, deux ou les trois peuvent être dégénérées. Si les trois rangées de cellules sont dégénérées, on parle de pancytopénie. Chez certains patients atteints du syndrome myélodysplasique, les cellules souches immatures se multiplient massivement et de manière incontrôlable au fil du temps. Le SMD se transforme alors en leucémie aiguë. C'est pourquoi un syndrome myélodysplasique est aussi appelé pré-leucémie.
Les raisons de cette dégénérescence de la formation de sang n'ont pas été clarifiées dans plus de 90 pour cent des cas (syndrome myélodysplasique primitif). Chez dix pour cent des personnes touchées, cependant, les déclencheurs peuvent être trouvés de manière plus ou moins fiable (syndrome myélodysplasique secondaire). Dans ce cas, les modifications chromosomiques sont généralement évidentes dans la constitution génétique. Plus il y a de changements chromosomiques, plus le tableau clinique est grave. Les déclencheurs comprennent :
- Chimiothérapie antérieure avec des toxines cellulaires (cytostatiques)
- Rayonnement (par exemple, pour traiter le cancer ou dans les accidents nucléaires)
- Thérapie à l'iode radioactif (pour l'hyperthyroïdie ou le cancer de la thyroïde)
- Benzène et autres solvants
Syndrome myélodysplasique : investigations et diagnostic
La bonne personne à contacter si vous suspectez un syndrome myélodysplasique est un spécialiste en médecine interne spécialisé dans les troubles sanguins ou le cancer (hématologue, hémato-oncologue). Lors du rendez-vous chez le médecin, le médecin s'enquiert d'abord de vos symptômes actuels et de toute maladie antérieure (anamnèse). Si vous suspectez un syndrome myélodysplasique, le médecin pourrait vous poser les questions suivantes, par exemple :
- Avez-vous été fatigué et épuisé ces derniers temps, ou avez-vous remarqué une baisse de performance ?
- Vous vous essoufflez facilement même avec peu d'efforts physiques ?
- Avez-vous des palpitations fréquentes ou des vertiges?
- Avez-vous souffert d'infections ces derniers temps?
- Êtes-vous sujet à des hémorragies cutanées ponctuelles (pétéchies) et à une augmentation des saignements de nez ?
- Avez-vous déjà subi une radiothérapie ou une chimiothérapie?
Après l'anamnèse, l'examen physique suit. Le médecin vérifie principalement si le foie ou la rate sont hypertrophiés et si les ganglions lymphatiques sont enflés. Le syndrome myélodysplasique étant avant tout une maladie du sang, un test sanguin est indispensable. Il sert également, entre autres, à clarifier d'autres causes possibles des symptômes.En plus du sang, la moelle osseuse est également examinée si un syndrome myélodysplasique est suspecté.
Syndrome myélodysplasique : prise de sang
La première indication d'un syndrome myélodysplasique est un test sanguin. L'échantillon examiné contient généralement moins de cellules sanguines que chez une personne en bonne santé. Les différents types de cellules peuvent être affectés dans différentes combinaisons ou seuls. La plupart du temps, les globules rouges sont diminués (anémie). Contrairement à l'anémie ferriprive, la teneur en fer de ces cellules n'est pas modifiée ni même augmentée. De plus, les globules blancs et les plaquettes peuvent être diminués (leucopénie et thrombocytopénie). Cependant, parfois, les globules blancs sont également augmentés.
Un syndrome myélodysplasique peut affecter la taille et la teneur en hémoglobine des cellules sanguines en plus d'une modification du nombre de cellules. Les globules rouges peuvent être agrandis (macrocytaires) ou réduits (microcytaires), avoir une forme différente et une teneur en hémoglobine diminuée (hypochrome) ou augmentée (hyperchrome). La formule sanguine est utilisée pour évaluer s'il y a plus de cellules précurseurs sanguines immatures. C'est aussi une indication d'une altération de la formation du sang. Afin de clarifier d'autres causes possibles des symptômes, le niveau de stockage du fer ferritine et le paramètre de dégradation cellulaire LDH sont également déterminés dans le sang. La vitamine B12, l'acide folique et l'érythropoïétine sont impliqués dans la formation du sang et sont donc souvent également contrôlés.
Syndrome myélodysplasique : ponction de la moelle osseuse
Si un test sanguin anormal suggère un syndrome myélodysplasique, une biopsie de la moelle osseuse peut confirmer le diagnostic suspecté. Parce que dans le MDS aussi, de plus en plus de précurseurs immatures (blastes) de la formation normale du sang peuvent être trouvés dans la moelle osseuse. Au cours de cet examen, le patient reçoit généralement des somnifères sédatifs ou légers. L'anesthésie générale est généralement pratiquée sur les enfants. Ensuite, une zone de la crête iliaque ou du sternum est désinfectée et recouverte de linges stériles. Pour éviter que le patient ne développe de douleur lors de la biopsie, un anesthésique local est injecté sous la peau. Le médecin peut ensuite utiliser une aiguille pour retirer les cellules et les tissus de la moelle osseuse. Ensuite, les cellules et les tissus sont examinés en laboratoire. Pour le traitement ultérieur du syndrome myélodysplasique, il est important de prouver si et comment le matériel génétique des cellules de la moelle osseuse a été modifié. Ceci est réalisé avec une analyse chromosomique ou génétique.
Syndrome myélodysplasique : traitement
Un syndrome myélodysplasique est déterminé et classé selon l'aspect et la nature de la moelle osseuse et des cellules sanguines au microscope. En fonction des modifications microscopiques des cellules hématopoïétiques, l'Organisation mondiale de la santé (OMS) distingue deux types de myélodysplasie, dont chacun nécessite des mesures thérapeutiques différentes : le SMD à haut risque et le SMD à faible risque. Les critères de cette classification comprennent le type et la proportion de cellules modifiées dans le sang et la moelle osseuse. Le SMD est traité dans les services spécialisés d'un hôpital ou, particulièrement recommandé, d'une clinique universitaire.
Syndrome myélodysplasique : traitement des SMD à faible risque
Dans le cas d'un SMD à faible risque, une « thérapie de soutien » est utilisée, qui fait référence au traitement de soutien de la maladie. On essaie de remplacer la perte de fonction sans pouvoir guérir la maladie. Le syndrome myélodysplasique peut nécessiter les mesures de soutien suivantes :
- Transfusion de globules rouges et blancs ou de plaquettes
- Médicaments qui fixent le fer dans le sang (chélateurs du fer). Cela est nécessaire car les transfusions sanguines répétées provoquent une surcharge en fer dans le corps.
- Administration précoce d'antibiotiques pour toute infection incertaine
- Vaccination contre les pneumocoques et vaccination annuelle contre la grippe
- Évitez d'utiliser des analgésiques non stéroïdiens ou de la cortisone
Syndrome myélodysplasique : facteurs de croissance
Un syndrome myélodysplasique entraîne une diminution de la concentration cellulaire de certains types de cellules dans le sang. Pour que le corps produise davantage de nouvelles cellules de ce type de cellules, la formation de sang peut être stimulée par certains médicaments. L'hormone érythropoïétine (également appelée EPO dans le dopage sportif) ou l'acide valproïque peuvent être administrés pour augmenter le nombre de globules rouges. Pour les autres rangées de cellules, il existe également des stimulateurs qui stimulent la formation de nouvelles cellules.
Syndrome myélodysplasique : Immunomodulateurs
Le syndrome myélodysplasique affecte également les cellules du système immunitaire. Dans certains cas, des médicaments qui suppriment ou modulent le système immunitaire peuvent aider. À long terme, cela signifie que les patients auront moins de transfusions sanguines. Cette thérapie peut également entraîner une nouvelle augmentation du nombre de plaquettes dans le sang.
Syndrome myélodysplasique : traitement des SMD à haut risque
Il existe plusieurs options pour traiter le syndrome myélodysplasique dans le groupe à haut risque, notamment la modification du métabolisme de l'ADN (par exemple avec de l'azacytidine ou de la décitabine), une chimiothérapie intensive ou une « allogreffe de cellules souches ». La greffe de cellules souches est la seule option de traitement qui peut potentiellement guérir la maladie. Toutes les cellules de la moelle osseuse du patient sont détruites par la radiothérapie et la chimiothérapie. Puisqu'une personne ne peut pas vivre sans formation de sang, les cellules souches du donneur doivent être implantées par une autre personne. Ceux-ci se divisent et recommencent la formation du sang. Cependant, il n'est pas toujours facile de trouver un donneur suffisamment similaire génétiquement pour être qualifié de donneur.
En principe, la possibilité d'une greffe de cellules souches doit être examinée chez tous les patients atteints de SMD à haut risque avant, par exemple, d'interférer avec le métabolisme de l'ADN. Si une greffe de cellules souches n'est pas possible, les autres méthodes de traitement sont utilisées.
Syndrome myélodysplasique : évolution de la maladie et pronostic
Dans l'ensemble, le pronostic du SMD est plutôt sombre. Les facteurs particulièrement défavorables sont une proportion élevée de blastes dans le sang, des modifications chromosomiques complexes, un niveau élevé de décomposition cellulaire dans le test sanguin, la vieillesse, des maladies antérieures et un état général réduit.
Selon le groupe à risque, le diagnostic de « syndrome myélodysplasique » diffère entre l'espérance de vie et l'évolution de la maladie. Les patients à haut risque survivent en moyenne cinq mois. Cependant, dans les SMD à haut risque, il existe parfois la possibilité d'une thérapie par cellules souches et donc une chance potentielle de guérison. S'il existe un type de maladie à faible risque, l'espérance de vie peut augmenter jusqu'à 68 mois en moyenne. Plus de 60 % meurent d'infections, de saignements ou d'une leucémie myéloïde aiguë (LAM) soudaine. Ces complications sont une conséquence directe du syndrome myélodysplasique.
Mots Clés: grossesse diète peau
.jpg)